|
iiiiiiiii | Juin – Juillet 2017 |
| iiiiiiiii |  |
|
 |
||
– Dans le numéro 229 de Spectra Biologie –
Consultez gratuitement nos vidéos et interviews !
Témoignages-client (sponsorisés)
 |
Innovations |
MilliDrop Analyzer, de la recherche à la phase industrielle
Au Forum LABO 2017, Millidrop a remporté le Trophée de l’innovation dans la catégorie Miniaturisation et le Trophée de l’innovation française, valorisant la meilleure innovation d’une société à capitaux majoritairement français, pour le Millidrop Analyzer Azur.
Après dix ans de recherche, la start-up MilliDrop lance une première génération d’analyseurs de microbiologie haut débit, où le milieu de culture passe à l’échelle de la goutte.
« Avant, il fallait un opérateur manipulant une seringue, maintenant une plaque suffit », déclare Laurent Boitard, de la 121e promotion de l’École supérieure de chimie et de physique industrielles de la ville de Paris (ESPCI), président co-fondateur de MilliDrop et l’un des dix jeunes innovateurs récompensés en mai 2016 parmi les meilleurs talents français selon le MIT Technology Review.
MilliDrop, société spin-off du laboratoire de colloïdes et matériaux divisés (LCMD) de l’ESPCI, dirigé par Jérôme Bibette, a été créée en 2015. Aujourd’hui, elle est intégrée à l’incubateur de l’ESPCI au sein de l’Institut Pierre-Gilles de Gennes.
Sa qualité de lauréate du concours national d’aide à la création d’entreprise lui vaut le soutien de la SATT IdF Innov pour développer un prototype issu d’un projet alors bien ficelé à l’intérieur du laboratoire. « Nous avons accompagné un projet de preuve de concept au sein du laboratoire pour soutenir la création de MilliDrop Instrument », explique Béatrice Llirbat, présidente de la SATT IDF Innov. « Nous avons permis le passage d’un instrument de laboratoire à un prototype pré-industriel, essentiel pour convaincre la communauté scientifique d’adopter cette nouvelle technologie, préalable indispensable au démarrage de l’activité de la start-up. »
Depuis 2014, la SATT IDF Innov a octroyé plus de 300 k€ dans le projet du laboratoire LCMD.
L’idée d’appliquer la technologie millifluidique à la microbiologie est née en 2007 dans l’esprit de Jérôme Bibette, tandis que Laurent Boitard découvrant la possible application des technologies microfluidiques à la microbiologie développait un modèle pour automatiser culture et analyse de microorganismes. Deux thèses ont tourné sur une boîte en carton avant qu’en 2012, une première itération de machine avec modules et une première publication scientifique (1) voient le jour. Quelques post-doctorants et doctorants y travailleront, jusqu’à ce qu’en 2015 la société Valotec (émanation de l’École Normale Supérieure de Cachan) spécialisée dans le prototypage leur apporte son soutien.
Détection et comptage de colonies en temps réel
Au Forum LABO 2017, Interscience a remporté le Trophée de l’innovation dans la catégorie Productivité/Rentabilité et le Trophée « Coup de Cœur des visiteurs », qui distingue l’innovation ayant reçu le plus de votes des visiteurs, pour le ScanStation.
Lors de Forum Labo 2017, Interscience a présenté en avant-
première mondiale son nouveau système, le ScanStation. Brevetée, cette station de détection et de comptage automatique de colonies bactériennes en temps réel, réalise l’incubation, la détection et l’énumération sur 100 boîtes de Petri.
« Avec cette nouvelle technologie nous permettons aux microbiologistes de constater en vidéo la croissance bactérienne sur leurs boîtes de Petri. C’est le mélange d’une technologie classique, la boite de Petri, avec les dernières innovations de la robotique et de l’informatique. Cela permet de connaître les résultats d’analyse beaucoup plus tôt et avec précision », déclare Emmanuel Jalenques, co-directeur et directeur de la R&D.
Dès le début de l’incubation, chaque boîte de Petri est prise en photo toutes les 30 minutes : les colonies sont détectées et comptées dès leur apparition. La détection des colonies est ainsi faite à un stade précoce de leur développement et le résultat est connu 3 fois plus rapidement qu’avec une analyse classique (par exemple 8h au lieu de 24h). Le comptage automatique des colonies des 100 boîtes de Petri améliore efficacement la productivité. Le résultat du comptage des colonies est plus précis car la détection est réalisée avant confluence et recouvrement tout en dissociant les artefacts. Le contrôle s’effectue en temps réel : l’utilisateur peut découvrir en direct la croissance bactérienne des colonies et visionner la vidéo pendant/après l’incubation, avec les fonctions de zoom, de pause, de replay… Le zoom permet notamment de vérifier l’état des colonies et d’examiner de près leur développement.
Enfin, la traçabilité des analyses est assurée par l’archivage de toutes les données depuis le début de l’incubation jusqu’à la validation des résultats.
Entre autres fonctionnalités innovantes, le ScanStation propose :
– une architecture robotique : l’incubateur intègre un carrousel de 100 boîtes de Petri, un bras robotisé ultra-rigide pour plus de précision et de durabilité ainsi qu’un compteur automatique de colonies ultra-HD (brevet déposé) ;
– une pince à capteur de force : cette pince haute précision s’adapte aux boîtes de Petri, à l’endroit ou à l’envers, les saisit du carrousel et les dépose sur la zone de capture d’images du compteur automatique toutes les 30 minutes (brevet déposé) ;
– un incubateur à effet Peltier : les modules Peltier permettent une régulation à ± 1 °C de la température, une basse consommation d’énergie, sans fluide ni compresseur ;
– l’éclairage par les LED blanches et la caméra ultra-HD : 5 millions de pixels permettent une détection des colonies dès leur formation et un comptage ultra-précis ;
– une interface tactile permet de naviguer plus facilement dans le logiciel et d’accéder au contrôle des boîtes de Petri ;
– Multibatch : le chargement des boîtes peut se faire au début ou de manière fractionnée pendant l’incubation. Des boîtes de Petri peuvent donc continuellement être ajoutées quel que soit l’état du processus.
SOLIS+, un poste de sécurité microbiologique de type II avec vitre à bascule
Noroit a remporté le Trophée de l’innovation de Forum LABO dans la catégorie Ergonomie / Design / Confort pour le PSM Solis+.
Dernier-né de la gamme d’appareils de protection contre les risques de contamination biologique du fabricant Noroit, le poste de sécurité microbiologique (PSM) de type II Solis+ assure la protection tant de la manipulation que du manipulateur, mais aussi de l’environnement lorsqu’il s’agit de manipuler des agents pathogènes de classes 1 et 2. Respectant la norme en vigueur EN 12 469, ce PSM (Filtre absolu HEPA H14 au soufflage et à l’extraction, 99,999 %, pour toute particule > 0,3 µm ; vitesse du flux laminaire : 0,40 m/s, taux d’extraction > 35 % ; veine de garde stable et puissante : 0,53 m/sec) a été développé avec une attention particulière en matière d’ergonomie et de nettoyabilité. Avec ce PSM, fini le difficile nettoyage de la face interne de la vitre de façade. Grâce au dispositif breveté de basculement de la vitre « Twist and Clean® », le manipulateur peut décontaminer tout l’intérieur du PSM. La commande électrique par pédales de la vitre de façade permet au manipulateur d’entrer facilement son matériel à l’intérieur. Enfin, les bords latéraux du PSM également en vitre transparente et les bandeaux d’éclairage positionnés sur les côtés (dispositif « Solis Light Wing® »), contribuent à la convivialité du poste de travail. Conçu en interne par la société française Noroit, créée il y a 10 ans par deux spécialistes de la protection par flux laminaire et de l’isotechnie, Gilles Mahé et Pascal Sidaner, ce PSM présente un caractère innovant tel qu’il a remporté le Trophée de l’innovation de Forum LABO dans la catégorie Ergonomie / Design / Confort.
Une armoire de sécurité vitrée anti-feu 30 minutes en bois compressé
Trionyx a remporté le Trophée de l’innovation de Forum LABO dans la catégorie Sécurité au Laboratoire / Éco conception pour l’armoire de sécurité anti-feu.
Depuis la fin des années 90, la fabrication d’armoires de sécurité est devenue la principale activité de la société française Trionyx, créée en 1971 dans le secteur de l’outillage et de la fourniture industrielle.
Une toute nouvelle vient de sortir des 4 000 m2 de l’atelier de confection situé à Dreux : une armoire pour produits inflammables 30 minutes, à portes vitrées avec charnières et armatures métalliques mais structure en bois compressé. Ce qui signifie qu’elle résiste 30 minutes à un feu extérieur de 1 000 °C, avec une température intérieure inférieure à 160 °C. Les portes vitrées équipées d’un verre anti-feu constituent un véritable défi technique de résistance au feu. Leur fermeture trois points est thermorégulée grâce à un fusible positionné au niveau d’un vérin de la porte, et s’opère automatiquement à 65°C. Cette armoire fabriquée en France et développée par des capitaux 100 % français est conforme non seulement à la norme européenne EN 14470–1 mais aussi à la norme américaine FM 6050, également pour le stockage des produits inflammables en version portes pleines. En cours de certification pour cette nouvelle version portes vitrées, elle a remporté les Trophées de l’innovation Forum LABO 2017 dans la catégorie Sécurité au Laboratoire / Éco conception.
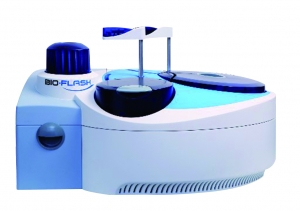
MICI : un nouveau test en chimiluminescence
Werfen Inova Diagnostics (San Diego, CA, US), leader mondial dans les réactifs et instruments de diagnostic des maladies auto-immunes, vient de lancer son nouveau test : le Quanta Flash® Calprotectin.
Les troubles gastro-intestinaux sont une cause de consultation médicale importante dans le monde entier. La conjonction de la détection de la calprotectine fécale et des signes cliniques est une aide au diagnostic des Maladies Inflammatoires Chroniques de l’Intestin (MICI : rectocolite hémorragique ou maladie de Crohn). Elle permet aussi de les différencier du syndrome du côlon irritable. La détection précise du taux de calprotectine dans les selles contribue à une meilleure maîtrise des coûts de santé, et apporte au clinicien une information précise afin de choisir le traitement le plus approprié.
Ce nouveau test de chimiluminescence permet la détermination quantitative de la calprotectine fécale en 30 minutes. Il est d’ores et déjà disponible dans tous les pays soumis aux normes CE. Quanta Flash® Calprotectine est l’un des 32 tests d’auto-immunité réalisable en simultané sur Bio-Flash® (Instrument de chimiluminescence en accès continu).
Evaluer le risque de lésions rénales aiguës
Ortho Clinical Diagnostics (Ortho) a fait connaître la disponibilité de son nouveau test, Vitros® Nephrocheck® , le premier test entièrement automatisé pour évaluer le risque de lésions rénales aiguës, un problème grave et potentiellement mortel affectant les patients hospitalisés dans le monde entier.
L’insuffisance rénale aiguë (IRA), la perte soudaine de la fonction rénale, peut se développer brusquement. Elle est associée à des problèmes d’insuffisance rénale et à une forte mortalité. Connu comme un tueur silencieux, l’AKI (Acute Kidney Injury) est aussi fréquente et deux fois plus mortelle qu’une crise cardiaque, ce qui entraîne jusqu’à deux millions de décès par an dans le monde. L’IRA est causée par un stress rénal consécutif à une chirurgie majeure, des drogues, des toxines, une infection grave ou une maladie chronique et un traumatisme. Jusqu’à 50 pour cent des patients en soins intensifs développent un certain stade de l’IRA.
Le test Nephrocheck® peut être réalisé sur le système Vitros 3600 entièrement automatisé d’Ortho et le système intégré Vitros 5600. Il s’agit d’un test simple sur urine qui fournit des résultats au laboratoire en 16 minutes, permettant aux cliniciens d’évaluer le risque d’IRA et de traiter de façon proactive les patients à risque. Les performances de ce test sont améliorées grâce aux technologies et aux avantages exclusifs disponibles uniquement sur les systèmes Vitros® d’Ortho.
La technologie MicroWell Vitros augmente les capacités de liaison avec un procédé de revêtement unique. La technologie de détection de la chimiluminescence amplifiée assure des gammes de linéarité étendues, une précision et une haute exactitude des immunodosages pour de nombreux états pathologiques. Cette technologie offre de grandes sensibilités et précisions et permet la prise en charge de petits volumes tout en minimisant les déchets (faible taille des micropuits).
Le nouveau test d’Ortho a été développé sous une licence d’Astute Medical. Il a été identifié et validé comme un outil d’évaluation des risques modérés à graves d’IRA, dans le cadre de deux études cliniques internationales incluant 1 200 patients au total. Il est capable de doser de façon précise deux biomarqueurs, TIMP-2 et IGFB-7, pour détecter l’insuffisance rénale. Lorsque ces protéines sont retrouvées à un taux élevé, ce qui peut survenir sans aucun signe clinique ni symptôme clair, cela indique un stress rénal qui précède la survenue de lésions. Ce test permet donc de détecter les patients les plus susceptibles de développer une IRA et de prévenir l’évolution de la maladie grâce à une prise en charge médicale rapide.
Détecter les EPC via la technologie MALDI
Bruker a lancé lors du dernier congrès de l’ECCMID 2017 à VIENNE (Autriche), le premier kit diagnostic marqué CE-IVD pour la détection des résistances aux carbapénèmes par spectrométrie de masse permettant à la plateforme MALDI Biotyper™ d’être plus versatile et polyvalente. Le test MBT IVD STAR-Carba™ permet une détection rapide (30 à 60 minutes à partir de la culture) des mécanismes de résistances enzymatiques des principales classes de carbapénèmases A, B ou D pour les entérobactéries à Gram Négatif, les espèces Pseudomonas et les espèces Acinetobacter.
Ce nouveau test apporte une standardisation et une analyse non subjective concernant la détection des EPC sur la base d’une approche moléculaire non phénotypique.
Ce workflow MBT STAR-BL™ a fait l’objet depuis 2011 de nombreuses publications prouvant ses performances. D’autres kits marqués CE-IVD de détection des résistances sont en cours de développement.
C. Difficile et GBS en Point of Care
La société québécoise GenePOC Inc. a débuté la commercialisation de ses deux premiers tests marqués CE-IVD, GenePOC™ CDiff (Clostridium difficile) et GenePOC ™ GBS (Group B streptococcus) sur la plateforme revogene™ qui a récemment obtenu le marquage CE-IVD. « Le test GenePOC CDiff répondra à la demande croissante du marché pour des tests abordables, entièrement automatisés et faciles à utiliser en Point of Care, car la détection précoce de C. difficile peut conduire à un meilleur contrôle et à une meilleure gestion de l’infection, ce qui peut améliorer la santé des patients et réduire le risque de transmission, de mortalité et de morbidité », a commenté Patrice Allibert, PDG de GenePOC. Ce lancement constituant une étape clé dans l’évolution des opérations commerciales de GenePOC, la société a mis en place de nombreux partenariats de distribution pour couvrir l’Europe et le Moyen-Orient grâce à des acteurs locaux. BioSynex Group en France, Mediphos Group BV aux Pays-Bas, en Belgique et au Luxembourg ou encore les Laboratoires Bühlmann en Suisse font partie de la liste de ces partenaires ; liste qui devrait s’allonger progressivement pour couvrir tout le globe. Au-delà du test, GenePOC espère que ce lancement favorisera l’installation de la plateforme revogene™ dans les laboratoires.
GenePOC™ est une société spécialisée dans le développement de dispositifs de diagnostic rapide visant la prévention et la détection des maladies infectieuses. Elle a conçu le système de diagnostic GenePOC, qui permet des tests microbiens rapides au point de soins (POC) : l’instrument revogene™ peut analyser tout type d’infection en une heure au plus, est facile à utiliser et traite d’une large gamme d’échantillons biologiques, ce qui en fait un outil convivial et efficace.
Cette société québécoise est membre du groupe Debiopharm, un groupe mondial biopharmaceutique, basé en Suisse, de cinq entreprises actives dans le monde entier dans le domaine du développement et de la fabrication de médicaments et d’outils de diagnostic. Le groupe se concentre sur les besoins médicaux non satisfaits.
 |
Actualités |
Diagast se donne les moyens de sa croissance
Fin mai, l’acteur majeur du marché de l’Immuno-Hématologie Diagast a annoncé le succès de son augmentation de capital en numéraire avec maintien de l’Etablissement Français du sang (EFS) comme actionnaire majoritaire.
Cette société privée qui développe, produit et commercialise des réactifs et des systèmes automatisés permettant notamment la détermination des groupages sanguins a vu les groupes GEI et IRD entrer dans le capital et devenir deux nouveaux actionnaires minoritaires.
Cette augmentation de capital s’est réalisée dans le but de répondre à de nombreux projets d’investissements nécessaires à sa croissance, en particulier des projets en R&D et industriels pour ses nouvelles gammes de produits ainsi que des investissements pour le doublement du site de production.
Bruno Morino, PDG de la société depuis 2011, a souhaité dès son arrivée mettre en œuvre un nouveau plan de croissance pour assurer un développement significatif de l’entreprise. Le Groupe a réalisé une croissance de son chiffre d’affaire de 25,5 % ces cinq dernières années avec un fort développement à l’international. Il a également investi significativement dans l’innovation avec l’acquisition de la biotech ABO Diag en 2014. Il signe, avec cette augmentation de capital, un nouveau virage stratégique pour Diagast.
Doté de plus de 150 M€, GEI est un fonds d’investissement indépendant, principalement souscrit par des entrepreneurs, qui apportent leur expertise sectorielle ou métier aux dirigeants des participations. Sans approche sectorielle exclusive ni dogme en matière d’emploi des fonds apportés, leur stratégie consiste à accompagner des PME rentables et en croissance, dans des contextes de développement ou de transmission.
Filiale du Groupe IRD, Nord Croissance se positionne sur le financement en fonds propres de projets de développement, de transmission et de reclassement de minorités et est un partenaire actif des entreprises situées en Hauts-de-France.
Illumina investit le DPNI en Europe
Illumina, Inc. a lancé ce printemps sa solution DANNI VeriSeq™, une approche basée sur un séquençage de nouvelle génération (NGS) marquée CE-IVD pour le dépistage prénatal non invasif (DPNI) incluant un logiciel de préparation de bibliothèque et d’analyse marqué CE-IVD, qui permet aux laboratoires européens d’effectuer un DPNI efficace et extrêmement précis en interne.
Cette solution fournit des informations précises sur le statut chromosomique fœtal dès la 10e semaine de gestation à l’aide d’un simple prélèvement de sang de la mère. Ce dépistage vise la trisomie 21, la trisomie 18, la trisomie 13, ainsi que certains troubles liés au chromosome sexuel. En raison de sa haute sensibilité et de sa haute spécificité, ce DPNI minimise la nécessité de recourir à des procédures de test invasives, telle que les amniocentèses.
La solution automatisée fournit des réactifs, des instruments, l’installation et la formation et permet des délais d’exécution inédits ; les laboratoires peuvent traiter jusqu’à 96 échantillons en un jour environ. Illumina a mené une étude clinique rigoureuse, sur plus de 3100 échantillons maternels, qui a déterminé que la solution DANNI VeriSeq™ non seulement fournissait des résultats extrêmement sensibles et spécifiques pour les trisomies 21, 13 et 18, mais démontrait aussi un niveau élevé de concordance pour les aneuploïdies chromosomiques sexuelles signalées.
Dispositifs médicaux : nouvelles réglementations
Un accord a enfin été conclu sur les nouvelles réglementations relatives aux dispositifs médicaux, qui sont officiellement entrées en vigueur en mai 2017. Les réglementations remplaceront la Directive actuelle sur les dispositifs médicaux (93/42/EEC), ainsi que la Directive relative aux dispositifs médicaux implantables actifs (90/385/EEC) et la Directive relative aux dispositifs médicaux de diagnostic in vitro (98/79/CE).
Les règlements représentent une révision fondamentale des directives précédentes destinée à établir un cadre réglementaire transparent, prévisible, et durable pour les dispositifs médicaux, ce qui assurera un niveau élevé de sécurité sanitaire tout en soutenant l’innovation. La réglementation concernant les dispositifs médicaux permet une période de transition de trois ans suite à la publication ; la mise en application complète est prévue pour 2020. En ce qui concerne les dispositifs médicaux de diagnostic in vitro (DMDIV), la réglementation entrera en application en 2022.
Pour les fabricants, les réglementations concerneront de nombreux processus critiques. Il ne faut donc pas sous-estimer les ressources qui seront nécessaires pour la transition ; il est fondamental que les fabricants des dispositifs médicaux élaborent une feuille de route robuste pour la mise en place, et désignent des gestionnaires de projet fiables et efficaces pour conduire les changements.
Synlab-Labco : un pas de plus vers l’entrée en bourse
Novo, holding du Novo Group (filiale de la Fondation Novo Nordisk), a investi dans Synlab Limited – la plus grande société européenne de laboratoires cliniques, issue de la fusion de Synlab et de Labco -, par l’acquisition de nouvelles actions pour un montant de 250 millions d’euros, représentant 10 % des capitaux propres du groupe Synlab. Novo, qui passe donc à 20 % du total des capitaux, souhaite en effet développer son vaste portefeuille de placements et entrer dans « l’industrie européenne des services de laboratoire ».
« Si la société est cotée en Bourse, nous serons en bonne position pour maintenir notre niveau de participation », a confié à Reuters Michael Shalmi, directeur général des grands investissements chez Novo.
Grâce à cet investissement, Synlab est maintenant valorisé à environ 4,5 milliards d’euros, tandis que sa dette nette s’établit à 2,125 milliards d’euros en décembre 2016.
Depuis sa création en 1998 et avant sa combinaison avec Labco, Synlab a poursuivi une stratégie de consolidation et de mise en place de laboratoires cliniques, environnementaux et vétérinaires individuels tout en élargissant ses activités à l’échelle internationale. Plus récemment, elle s’est associée à Labco SA, basée en France, lorsque l’entreprise européenne de private equity Cinven a acquis Synlab. Le groupe combiné aura son siège social à Munich.
Opérant dans 35 pays au total avec des revenus combinés d’environ 1,5 milliard d’euros, Synlab entreprend chaque année plus de 400 millions de tests diagnostiques pour près de 50 millions de patients.
Cinven demeure l’actionnaire majoritaire du Groupe et le Fonds de retraite des enseignants de l’Ontario conserve sa participation minoritaire. En tant qu’investisseurs à long terme, Novo, Cinven et Ontario Teachers, doivent fournir un soutien financier important pour le Groupe dans l’expansion continue de ses opérations et le lancement de nouveaux tests de diagnostic.
Des sanctions administratives pour les LBM
Le décret précisant les modalités d’application des sanctions administratives que peuvent prononcer les directeurs généraux d’agence régionale de santé (ARS) à l’encontre des laboratoires de biologie médicale (LBM) est paru dans le JO du 29 mars 2017 (1). Applicables depuis le 30 mars 2017, ces sanctions peuvent intervenir dès que le laboratoire commet une ou plusieurs des infractions énumérées à l’article L.6241–1 du code de la santé publique.
Ces infractions portent sur le respect des modalités de réalisation des différents examens de biologie médicale mais également sur des problématiques d’accréditation, de qualification dans certains domaines comme la procréation médicalement assistée, de contrôle qualité, de contrôle du capital des LBM, d’implantation de sites, d’information ou de déclaration à l’ARS.
En réaction à une suspicion d’infraction, le directeur général de l’ARS compétent dispose d’une procédure en plusieurs étapes :
1/ la notification au laboratoire des faits qui lui sont reprochés et des sanctions encourues ; le laboratoire doit communiquer dans le délai d’un mois, ses observations écrites et les mesures correctrices adoptées ou envisagées.
2/ Passé ce délai, soit l’ARS statue sur l’absence d’infraction, soit l’ARS approuve, le cas échéant, les mesures correctrices envisagées par le laboratoire et s’assure du respect de ses engagements. Si l’infraction reste établie au terme de la procédure contradictoire, l’ARS peut, dans un délai de deux mois, infliger une amende administrative au LBM. Celle-ci peut s’élever à 500 000 euros pour manquement aux règles de bonne pratique du LBM, d’implantation territoriale, de facturation des examens, d’information du public, etc. Elle peut atteindre 2 millions d’euros s’il y a fonctionnement sans accréditation.
L’ARS peut également mettre en demeure l’auteur de l’infraction de prendre toutes les dispositions nécessaires et de faire cesser définitivement les infractions dans un délai maximal de 15 jours, sous peine d’une astreinte journalière (dans la limite de 5000 euros par jour) jusqu’à régularisation de la situation.
En cas d’infractions graves et répétées, la fermeture temporaire, partielle ou totale du LBM peut être prononcée. La décision est notifiée au laboratoire, accompagnée des constatations faites et assortie, le cas échéant, d’une injonction de remédier aux manquements dans un délai maximal de 15 jours. S’il est remédié à ces manquements, l’ARS prend acte de la régularisation de la situation. Sinon, une fermeture définitive est possible.
Enfin, pour les infractions relatives aux examens d’anatomie et de cytologie pathologiques, l’ARS peut prononcer la suspension immédiate du droit d’exercer du biologiste médical, responsable ou co-responsable ou du médecin spécialiste qualifié en anatomie et cytologie pathologiques coresponsable du LBM.
Élection du nouveau bureau de la FNSIP-BM
A l’occasion du congrès de la Fédération Nationale des Syndicats d’Internes en Pharmacie et Biologie Médicale (FNSIP-BM) qui s’est tenu à Toulouse le 20 mai dernier, le nouveau bureau national a été élu à l’unanimité par le conseil d’administration. Les nouveaux co-présidents Geoffroy Maquin, interne en Pharmacie Hospitalière à Marseille, et Morgane Moulis, interne en Biologie Médicale à Amiens, ainsi que leur bureau paritaire composé de 12 internes issus de différentes villes et hôpitaux de France, succèdent à Clément Delage, Jean-Victor Reynaud et leur équipe, unanimement remerciés et félicités pour leur bilan annuel.
Ces nouveaux élus poursuivront la mise en œuvre de la réforme du 3e cycle des études de médecine, qui encadre le DES de Biologie Médicale. Ils auront aussi à promouvoir les attentes des internes dans la réforme du 3e cycle des études de pharmacie qui engage une modification profonde des DES de Pharmacie et d’Innovation Pharmaceutique et Recherche. Ces actions seront menées en parallèle des discussions sur la réforme des cycles courts de pharmacie que sont les filières officine et industrie.
Cette actualité législative permettra au bureau national de pérenniser les relations que la fédération a développées et entretenues ces dernières années avec de nombreuses autres organisations étudiantes et des partenaires spécifiques à chaque filière représentée par la fédération. De plus, le nouveau bureau élu se félicite de la nomination respective de Mme Buzyn et Mme Vidal à la tête du ministère des solidarités et de la santé et du ministère de l’enseignement supérieur, de la recherche et de l’innovation, et il aura à cœur d’assurer la continuité des échanges avec leurs équipes.
La composition du bureau de la FNSIP-BM est la suivante :
– Co-présidents : Geoffroy Maquin (Pharmacie Hospitalière (PH-PR), Marseille) et Morgane Moulis (Biologie Médicale, Amiens)
– Secrétaire général : Hugo Campario (Innovation Pharmaceutique et Recherche, Dijon)
– Trésorier : Romain de Jorna (Pharmacie Hospitalière (PH-PR), Montpellier)
– Vice-présidents Biologie Médicale : Olivier Grunewald (Biologie Médicale, Lille) et Justine Demortier (Biologie Médicale, Bordeaux)
– Vice-président Pharmacie option PHPR : Nicolas Allaire (Pharmacie Hospitalière (PH-PR), Nantes)
Vice-présidente Pharmacie option PIBM : Justine Nasone (Pharmacie Hospitalière (PIBM), Montpellier)
– Vice-présidente Innovation, Pharmaceutique et Recherche : Camille Morival (Innovation Pharmaceutique et Recherche, Rennes)
– Vice-président Relations Universitaires : Rémi Pieragostini (Pharmacie Hospitalière (PH-PR), Paris)
– Vice-présidents Relations Internationales : Lise Durand (Pharmacie Hospitalière (PH-PR), Paris) et Moïse Michel (Biologie Médicale, Paris)
– Vice-présidente Partenariats : Aurélie Chaigneau (Pharmacie Hospitalière (PIBM), Paris)
– Vice-présidente Communication : Cornélie Fanton d’Andon (Biologie Médicale, Clermont-Ferrand)
Un test de détection rapide de la tuberculose
Des chercheurs américains ont mis au point un test sanguin qui devrait nettement accélérer le diagnostic et le traitement de la tuberculose, responsable de deux millions de morts par an dans le monde.
Ce test « surpasse tous ceux qui sont actuellement sur le marché et ne prend que quelques heures pour produire des résultats », selon ses inventeurs.
Ce test est le premier à mesurer la gravité de cette infection pulmonaire en détectant deux protéines dans le sang (CFP-10 et ESAT-6) que la bactérie responsable de la tuberculose libère seulement dans la phase active de la maladie. « Notre technologie peut être utilisée avec des instruments cliniques habituels que l’on trouve dans tous les hôpitaux », précise Tony Hu, un des chercheurs à l’Université d’Arizona.
Il peut détecter la tuberculose dans environ 92 % des cas chez des patients qui sont ou non co-infectés par le virus du VIH. Dans ce dernier cas, les techniques de dépistage actuellement utilisées peuvent être plus complexes.
« Les tests aujourd’hui sur le marché (cultures de sang, analyses des expectorations, biopsie des poumons, ponctions lombaires) sont les seules manières de diagnostiquer la tuberculose. […] Ils peuvent produire des faux négatifs et prennent plusieurs jours voire des semaines pour obtenir les résultats » souligne Tony Hu.
L’infection reste une épidémie mondiale sans vaccin efficace, et les souches de la bactérie résistantes aux traitements augmentent.
Marqueur du réservoir du VIH : une nouvelle piste pour éliminer le virus
Des chercheurs français ont identifié un marqueur qui permet de différencier les cellules « dormantes » infectées par le VIH des cellules saines. Cette découverte permettra d’isoler et d’analyser ces cellules réservoirs qui, en hébergeant silencieusement le virus, sont responsables de la persistance du virus même chez les patients sous traitements antirétroviraux, dont la charge virale est indétectable. Elle ouvre la voie à de nouvelles stratégies thérapeutiques par le ciblage des cellules infectées. Ces travaux s’inscrivent dans le cadre du programme stratégique de l’ANRS « Réservoirs du VIH ». Un brevet, en propriété CNRS, a été déposé sur l’utilisation diagnostique et thérapeutique du marqueur identifié.
Depuis 1996, la communauté scientifique s’accorde à penser que la guérison du VIH passera par le ciblage de ces « cellules réservoirs ». Le VIH, en latence, peut se cacher dans ces réservoirs pendant plusieurs dizaines d’années, échappant à la réponse immunitaire et aux traitements antirétroviraux, sans qu’aucune protéine virale ne soit exprimée. Mais en cas d’arrêt du traitement, le virus se multiplie massivement et la maladie progresse de nouveau. Les patients sont ainsi contraints à un traitement à vie. Pour envisager d’éliminer ce virus dormant, la première étape consistait à pouvoir distinguer les cellules réservoirs infectées par le VIH de leurs cellules homologues saines, très ressemblantes.
Partant de l’hypothèse que le VIH pourrait laisser une empreinte à la surface de sa cellule hôte, les chercheurs ont tout d’abord travaillé in vitro. Une comparaison entre cellules infectées et cellules saines les a conduits à remarquer une protéine particulière, codée par un gène parmi la centaine exprimés de manière spécifique par les cellules infectées. Présente uniquement à la surface des cellules infectées, la protéine CD32a remplissait dès lors in vitro les critères d’un marqueur de cellules réservoirs.
Les expérimentations sur échantillons cliniques l’ont ensuite confirmé. Dans les prélèvements de sang de 12 patients vivant avec le VIH et sous traitement, les chercheurs ont isolé les cellules exprimant le marqueur et ont constaté qu’elles étaient quasiment toutes porteuses du VIH. In vitro, l’activation de ces cellules a induit une production de virus capables de réinfecter des cellules saines tandis que leur élimination a provoqué un retard important de la production virale.
Dans la lutte contre le VIH, cette découverte ouvre la voie à une meilleure connaissance fondamentale des réservoirs viraux, qui pourront désormais être isolés facilement et analysés directement. A plus long terme, elle devrait déboucher sur des stratégies thérapeutiques visant à éliminer de l’organisme le virus latent.
Un microfilet pour attraper des cellules tumorales circulantes
Issue d’une synergie entre le LAAS-CNRS, l’Institut universitaire du cancer de Toulouse et le CHU de Rangueil, la start-up SmartCatch a mis au point un dispositif de capture in vivo des cellules tumorales circulantes (CTC). Ce dispositif promet d’améliorer le suivi et la caractérisation du cancer.
Dès son apparition, une tumeur solide diffuse dans le sang des cellules tumorales. La quantification et l’analyse de ces CTC permet de pronostiquer et de diagnostiquer le cancer, encore faut-il isoler ces cellules. La majorité des outils actuels repose sur le filtrage in vitro de cellules tumorales à partir d’un prélèvement sanguin, un travail encore peu sensible et peu spécifique.
Le Laboratoire d’analyse et d’architecture des systèmes (LAAS) du CNRS en association avec deux oncologues de l’Institut universitaire du cancer de Toulouse et du CHU de Rangueil, a su combler ce gap technologique en insérant un microfilet directement dans la circulation sanguine. De cette idée initiale est né le dépôt d’un brevet en 2015 puis la création de la start-up SmartCatch en septembre 2016. Actuellement, ses quatre fondateurs préparent la phase de certification du produit, et s’apprêtent à débuter les tests chez les patients.
En pratique, il s’agit d’insérer pendant quelques minutes dans la veine du patient un cathéter, à l’extrémité duquel se greffe un filet de 200 microns de diamètre très efficace, conçu par simulation et qui ne retient que les CTC, cellules plus grosses et plus rigides. L’utilisation d’un dispositif in vivo permet de sonder un volume sanguin plus représentatif qu’un échantillon de sang. Le suivi et la caractérisation de la maladie seront donc plus précis.
« Il s’agira de réaliser des biopsies liquides de la tumeur à haute valeur ajoutée, avec une qualité de matériel recueilli accrue, pour une utilisation clinique répétée tout au long du parcours de soin du patient », précise Aline Cerf, l’une des quatre fondateurs de Smartcatch. Ainsi, en surveillant la variation du nombre de cellules tumorales circulantes, il sera possible d’en déduire l’efficacité d’un nouveau traitement administré au patient et de l’adapter. Mais les applications possibles ne s’arrêtent pas là. Les cellules récupérées avec cette méthode étant encore vivantes, elles pourront être mises en culture pour étudier leurs mutations génétiques et tester les traitements avant leur administration au patient. Enfin, comme les minuscules tumeurs, indétectables par les examens classiques, essaiment également des cellules tumorales circulantes dans le sang, il parait envisageable d’utiliser ce dispositif comme outil de dépistage pour déceler très précocement ces tumeurs en devenir.
 |
Egalement dans Spectra Biologie n° 229 |
-
MANIFESTATION
SFIL : Partie 2
Biologie et territoires de santé
-
MANIFESTATION
25e Congrès de la Société Française de Toxicologie Analytique (SFTA)
et 54e Congrès de la Société de Toxicologie Clinique (STC)
-
MISE À JOUR DES CONNAISSANCES
La cryptococcose
André PAUGAM, Naïma DAHANE, Nadia GUENNOUNI, Patrice BOUREE -
MISE À JOUR DES CONNAISSANCES
L’Histoplasmose : une mycose tropicale aux multiples aspects
Patrice BOUREE, André PAUGAM
-
MISE À JOUR DES CONNAISSANCES
Diagnostic de la pneumocystose humaine
Didier BASSET, Laurence LACHAUD
La Newsletter Spectra Biologie est une publication des Editions PCI
176, rue du Temple – 75003 Paris
Tél. : 01 44 59 38 38
www.spectrabiologie.fr – pci@pcipresse.com